Zone de service
Règlement sur les dispositifs médicaux de Taïwan
Nos experts en réglementation aident les fabricants à atteindre et à maintenir la conformité avec les exigences de la réglementation taïwanaise sur les dispositifs médicaux , en vous guidant dans le processus d'enregistrement, la documentation et la représentation locale afin de garantir un accès rapide et réussi au marché taïwanais.
Conformité réglementaire pour le Canada
Conformité réglementaire pour Taïwan
Le ministère taïwanais de la santé et du bien-être (MOHW) est le ministère gouvernemental responsable de la réglementation des soins de santé dans le pays. Il a pour mission d'améliorer la qualité des soins de santé, de prévenir et de contrôler les maladies infectieuses, de garantir la sécurité des aliments et des médicaments et de faciliter le développement technologique.
Au sein du ministère de la santé et des affaires sociales, la Taiwan Food and Drug Administration (TFDA) gère le système réglementaire relatif à la sécurité et à la qualité des aliments, des médicaments, des dispositifs médicaux et des cosmétiques. La TFDA rédige et met en œuvre les réglementations, accorde l'enregistrement des produits et l'approbation des essais cliniques, contrôle la fabrication et l'importation et mène des activités de surveillance de la sécurité des produits de santé.
En mai 2021, Taïwan a annoncé une nouvelleloi sur les dispositifs médicaux , qui modifie la classification des dispositifs médicaux, regroupe les produits par risque et par catégorie, et ajuste les frais d'enregistrement. Cette loi renforce également la surveillance post-commercialisation de la sécurité et de la qualité des dispositifs en imposant des règles pour les rappels de produits.
Obtenir de l'aide maintenant

Voies d'enregistrement à Taïwan
Enregistrement des dispositifs médicaux et des DIV
Dispositifs médicaux
L'approbation préalable à la mise sur le marché est nécessaire pour toutes les catégories de dispositifs médicaux avant l'entrée sur le marché taïwanais. La TFDA délivre une "licence d'autorisation de dispositif médical après approbation de l'enregistrement du produit".
Si aucun dispositif similaire n'a été approuvé auparavant par la TFDA, votre dispositif sera considéré comme un dispositif PMA à Taïwan. C'est le cas même si votre produit dispose d'un dispositif substantiellement équivalent (SE) approuvé par la FDA américaine.
Les dispositifs de classe II et III doivent être approuvés par leur pays d'origine avant d'être enregistrés à Taïwan.
Les dispositifs médicaux de classe I stérile, de classe I de mesure, de classe II et de classe III doivent être conformes aux exigences des BPF avant que la TFDA n'accorde des licences de produit.
Les organismes d'audit autorisés par la TFDA effectuent des inspections sur place pour les fabricants locaux selon les BPF et examinent la documentation du système de qualité (QSD) fournie par les fabricants étrangers.
Avant qu'un dispositif médical puisse être vendu à Taïwan, l'enregistrement de la documentation du système de qualité (QSD) de l'installation de fabrication est requis en plus de l'enregistrement du dispositif médical. L'enregistrement QSD n'est supprimé que pour les dispositifs médicaux de classe I (non stériles). Une licence QSD (obtenue après approbation de l'enregistrement QSD) à Taïwan est similaire à une bonne pratique de fabrication (GMP) pour les dispositifs médicaux.
DIV
La procédure d'enregistrement des DIV à Taïwan, supervisée par la TFDA, varie en fonction de la classe de risque du dispositif, comme pour les dispositifs médicaux.
DIV de classe I et II : ces dispositifs ne nécessitent pas d'enregistrement et sont soumis à des exigences réglementaires moins strictes que les dispositifs à risque plus élevé.
Classe III et nouveaux DIV : ces dispositifs doivent faire l'objet d'une procédure d'examen en deux étapes, comprenant des examens administratifs et techniques.
Le rôle d'un agent taïwanais dans l'enregistrement des dispositifs médicaux
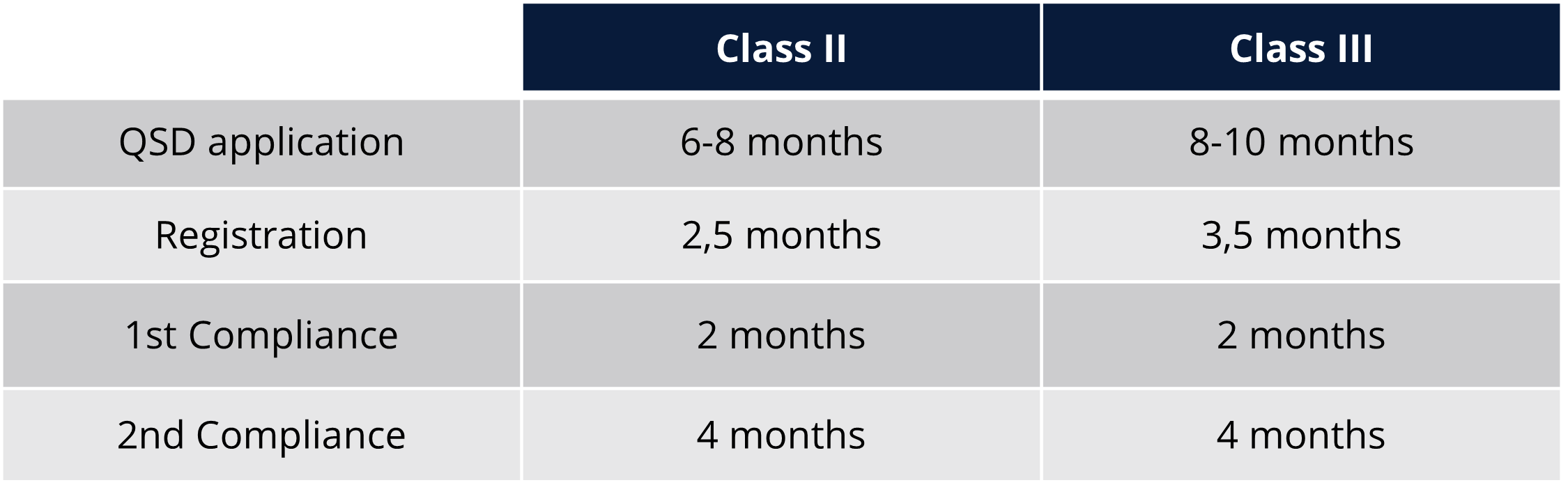
Délais et frais réglementaires pour Taïwan
Classe I (non stérile)
- Les dispositifs médicaux de classe I sans nom de marque (par exemple, les instruments chirurgicaux ou les accessoires électriques) suivent généralement un processus d'autodéclaration simple à Taïwan.
- Délai : Le processus d'approbation de l'enregistrement de la classe I prend environ 3 mois.
- Uneliste de dispositifs declasse I peut être enregistrée par le biais de la procédure d'inscription décrite à l'article 25 de la loi sur les dispositifs médicaux (Medical Devices Act), à compter du 1er octobre 2021.La liste contient 68 codes de dispositifs.
Liens importants et documents d'orientation
Étiquette ici
Représentant local
Pour vendre des dispositifs médicaux ou des diagnostics in vitro (DIV) à Taïwan, les fabricants qui n'ont pas de bureau local doivent désigner un représentant réglementaire dans le pays, un agent taïwanais. L'agent taïwanais assure la liaison avec la Taiwan Food and Drug Administration (TFDA) et joue un rôle essentiel dans le respect de la réglementation taïwanaise.
Votre agent taïwanais doit
- être une entité légalement établie à Taïwan
- être titulaire d'une licence de vente de produits pharmaceutiques lui permettant d'exercer des activités réglementaires.
L'agent taïwanais fournit un soutien réglementaire complet, y compris :
- Soumission de l'enregistrement : Préparation et soumission de tous les documents nécessaires à la TFDA en votre nom.
- Approbation du QSD : Aide à l'obtention de la lettre d'approbation de la documentation du système de qualité (QSD), qui est obligatoire pour les dispositifs de classe II, de classe III et certains dispositifs de classe I.
- Liaison réglementaire : Servir de lien réglementaire principal entre votre entreprise et la TFDA, en facilitant la communication et la conformité.
- Rapports sur les effets indésirables graves : Gestion des rapports sur les événements indésirables graves (SAE) en cas de problèmes liés à votre dispositif.
- Maintenance de la licence : Veiller à ce que la licence QSD et l'enregistrement du dispositif soient à jour.
- Gestion des licences de produits médicaux : Détenir votre licence de produit de dispositif médical approuvée par la TFDA, une exigence pour tous les dispositifs enregistrés.
Les coordonnées de votre agent taïwanais doivent figurer sur l'étiquette chinoise de votre dispositif, ainsi que le numéro d'enregistrement. En outre, les distributeurs ajoutent généralement leurs informations à l'aide d'un autocollant pour se conformer aux pratiques locales.
Le rôle de l'agent taïwanais est essentiel pour naviguer dans le paysage réglementaire complexe de Taïwan. Il s'assure que votre dispositif répond à toutes les exigences de la TFDA, maintient la conformité de votre produit et agit en tant que point de contact local pour les questions réglementaires.
Les fabricants peuvent en toute confiance développer leurs activités sur le marché taïwanais en désignant un agent taïwanais fiable, garantissant la conformité et un processus d'approbation sans heurts.
Contactez-nous pour savoir comment Qserve peut vous aider à nommer un agent taïwanais et à gérer vos besoins réglementaires à Taïwan.
Nous contacter
Services
Services Qserve pour Taïwan
Enregistrement des dispositifs médicaux et des DIV
Nous vous guidons tout au long du processus d'enregistrement des dispositifs médicaux et des diagnostics in vitro (DIV) auprès de la TFDA. De la préparation de la documentation à la soumission et au suivi, nos experts aident à rationaliser l'approbation et à réduire le temps de mise sur le marché, en garantissant la conformité avec les dernières attentes réglementaires.
Sélection de l'itinéraire d'enregistrement
Taïwan offre plusieurs voies d'enregistrement en fonction de la classe du dispositif, de l'historique des approbations dans d'autres pays et des données cliniques. Nous évaluons le profil de votre produit et vous conseillons sur la voie d'enregistrement la plus efficace et la plus rentable, notamment en tirant parti des homologations existantes aux États-Unis, dans l'Union européenne ou au Japon, le cas échéant.
Soutien au SMQ
La conformité aux exigences du système de qualité de la TFDA est un élément clé du processus d'enregistrement. Qserve soutient les fabricants avec : Nous vous aidons à identifier les lacunes, à aligner votre système de gestion de la qualité sur les attentes de la TFDA et à préparer votre organisation à des audits réussis et à une conformité à long terme.
Détention d'une licence (service d'agent taïwanais)
Les fabricants étrangers sont tenus de désigner un titulaire de licence local pour les représenter auprès de la TFDA. Qserve propose des services fiables de détention de licence et d'agent taïwanais, garantissant une interface conforme et professionnelle avec les autorités locales. Nous gérons les responsabilités réglementaires en votre nom, en maintenant la transparence et le contrôle.
Modifications et renouvellements
Les obligations réglementaires se poursuivent après l'approbation initiale. Qserve prend en charge la soumission des renouvellements de licences, des modifications de produits et des amendements afin de garantir une conformité continue tout au long du cycle de vie du produit.
Surveillance post-commercialisation (SPM) et soutien à la vigilance
La TFDA accorde une grande importance à la sécurité et aux performances post-commercialisation. Nous fournissons des conseils et une assistance pratique pour la planification du PMS, la déclaration des événements indésirables et les procédures de vigilance, afin de vous aider à rester conforme et réactif sur le marché taïwanais.
Classification et regroupement des dispositifs
Une classification et un regroupement précis sont essentiels pour déterminer les exigences réglementaires, les délais et les coûts. Qserve fournit des évaluations détaillées basées sur les directives de la TFDA pour s'assurer que votre dispositif est correctement catégorisé et groupé de manière optimale, évitant ainsi des retards ou des reprises inutiles.
Itinéraires d'enregistrement au Canada
Processus réglementaire
Si le fabricant de dispositifs médicaux de classe I ou de dispositifs de diagnostic in vitro souhaite commercialiser ses produits directement au Canada sans passer par un distributeur, il est tenu d'obtenir une licence d'établissement pour les dispositifs médicaux (LEMM). Si le fabricant opte pour une distribution par l'intermédiaire d'un ou de plusieurs distributeurs au Canada, il doit également se soumettre à la procédure de demande d'une licence d'établissement de dispositifs médicaux. En d'autres termes, les distributeurs et les importateurs basés au Canada doivent demander une licence d'établissement de dispositifs médicaux, quelle que soit la classification de risque du dispositif médical ou du dispositif de diagnostic in vitro.
Pour les fabricants de dispositifs de classe II-IV qui ont l'intention de vendre leurs produits, la demande d'une MDL est une condition préalable. La principale différence entre une MDEL et une MDL réside dans le fait que la MDL constitue une approbation du produit, tandis que la MDEL sert de permis à l'entreprise, au distributeur ou à l'importateur lui-même.
Pour obtenir une MDL, les fabricants doivent prouver qu'ils sont certifiés selon le système de gestion de la qualité ISO 13485 par le biais du Medical Device Single Audit Program (MDSAP). Cette certification doit être conforme aux spécifications énoncées dans le Règlement médical de Santé Canada.
Les deux procédures de demande de licence requièrent la soumission de documents en format électronique à Santé Canada, conformément aux exigences de soumission établies par Santé Canada.
Documents de référence
Accès au marché
Plus d'informations
Contactez-nous pour plus d'informations sur l'accès au marché taïwanais
Contactez-nous pour plus d'informations sur l'accès au marché taïwanais
services_médicaux
Classification des dispositifs médicaux à Taïwan
Le système réglementaire taïwanais classe les dispositifs dans les catégories I, II et III, sur la base du système de classification des dispositifs médicaux de la FDA américaine.
- Dispositif de classe I : Faible risque
- Dispositif de classe II :Risque modéré
- Dispositif de classe III :Risque élevé
Découvrez comment nous pouvons simplifier le processus d'entrée sur le marché taïwanais des dispositifs médicaux.
calendrier
Délais et frais réglementaires
Naviguer dans les réglementations taïwanaises relatives aux dispositifs médicaux peut s'avérer difficile, mais avec Qserve, vous bénéficiez d'un partenaire de confiance qui simplifie le processus. Que vous ayez besoin d'aide pour élaborer une stratégie ou pour gérer les exigences réglementaires, nous vous offrons un soutien sur mesure pour garantir un accès sans heurts au marché taïwanais.
Contactez-nous dès aujourd'hui pour savoir comment nous pouvons simplifier le processus d'entrée sur le marché taïwanais des dispositifs médicaux.
Étiquette ici
Exigences en matière de qualité et de conformité clinique
Exigences en matière de qualité et de conformité clinique
Étiquetage
L'étiquette et l'IFU doivent être rédigés en chinois.
Exigences relatives au personnel technique
L'article 15 de la loi sur les dispositifs médicaux stipule que les fabricants et les importateurs de dispositifs médicaux doivent nommer un personnel technique désigné, à compter du 1er mai 2021. Les mesures administratives relatives aux techniciens des dispositifs médicaux décrivent les exigences et les qualifications du personnel technique des dispositifs médicaux requis par tous les fabricants et revendeurs. Cette nouvelle exigence fera l'objet d'une période de transition de trois ans.
Exigences UDI
Taïwan a entamé une mise en œuvre progressive de l'UDI, y compris des exigences en matière d'étiquetage et d'établissement de rapports sur les bases de données. Les "Exigences relatives à l'indication de l'identifiant unique du dispositif sur les étiquettes des dispositifs médicaux" sont entrées en vigueur le 1er mai 2021. Les agences émettrices sont GS1, HIBCC et ICCBBA.
Obtenir de l'aide maintenant
server render fail/waiting for island-7f870ei1R0 (separate island render, inside)
