
Servicebereich
Taiwan Vorschriften für Medizinprodukte
Unsere Zulassungsexperten unterstützen Hersteller bei der Einhaltung der taiwanesischen Vorschriften für Medizinprodukte und begleiten Sie durch den Registrierungsprozess, die Dokumentation und die Vertretung vor Ort, um einen schnellen und erfolgreichen Marktzugang in Taiwan zu gewährleisten.
Einhaltung der Rechtsvorschriften für Kanada
Einhaltung der Rechtsvorschriften für Taiwan
Das taiwanesische Ministerium für Gesundheit und Wohlfahrt (MOHW) ist das für die Gesundheitsvorschriften des Landes zuständige Ministerium. Das MOHW hat ein umfassendes Mandat zur Verbesserung der Qualität des Gesundheitswesens, zur Prävention und Kontrolle von Infektionskrankheiten, zur Gewährleistung der Lebensmittel- und Arzneimittelsicherheit und zur Förderung der technologischen Entwicklung.
Innerhalb des MOHW verwaltet die Taiwan Food and Drug Administration (TFDA) das Regulierungssystem für die Sicherheit und Qualität von Lebensmitteln, Medikamenten, Medizinprodukte und Kosmetika. Die TFDA entwirft und setzt Vorschriften um, erteilt Genehmigungen für Produktregistrierungen und klinische Studien, überwacht die Herstellung und Einfuhr und führt Sicherheitsüberwachungsmaßnahmen für Gesundheitsprodukte durch.
Im Mai 2021 kündigte Taiwan ein neues Medizinproduktegesetz an, das die Klassifizierung von Medizinprodukten ändert, Produkte nach Risiko und Kategorie gruppiert und die Registrierungsgebühren anpasst. Außerdem wird die Überwachung der Sicherheit und Qualität von Produkten nach dem Inverkehrbringen durch Vorschriften für Produktrückrufe verstärkt.
Jetzt Unterstützung anfordern

Zulassungswege in Taiwan
Registrierung von Medizinprodukten und IVD
Medizinprodukte
Für alle Klassen von Medizinprodukten ist vor der Markteinführung in Taiwan eine Zulassung erforderlich. Die TFDA stellt eine "Lizenz für die Zulassung von Medizinprodukten nach Genehmigung der Produktregistrierung" aus.
Wenn keine ähnlichen Produkte zuvor von der TFDA zugelassen wurden, wird Ihr Produkt in Taiwan als PMA-Produkt betrachtet. Dies ist auch dann der Fall, wenn Ihr Produkt ein von der US-amerikanischen FDA zugelassenes, im Wesentlichen gleichwertiges (SE) Produkt hat.
Produkte der Klassen II und III müssen vor der Registrierung in Taiwan in ihrem Heimatland zugelassen werden.
Sterile Medizinprodukte der Klasse I, Messinstrumente der Klasse I, Klasse II und Klasse III müssen die GMP-Anforderungen erfüllen, bevor die TFDA Produktlizenzen erteilt.
Von der TFDA zugelassene Prüforganisationen führen vor Ort GMP-Inspektionen für lokale Hersteller durch und überprüfen die von ausländischen Herstellern vorgelegte Dokumentation des Qualitätssystems (QSD).
Bevor ein Medizinprodukt in Taiwan verkauft werden kann, ist neben der Registrierung des Medizinprodukts auch eine Registrierung der Qualitätssystemdokumentation (QSD) für die Produktionsstätte erforderlich. Auf die QSD-Registrierung wird nur bei Medizinprodukten der Klasse I (nicht steril) verzichtet. Eine QSD-Lizenz (die nach Genehmigung der QSD-Registrierung erteilt wird) ist in Taiwan vergleichbar mit einer guten Herstellungspraxis (GMP) für Medizinprodukte.
IVD
Das Registrierungsverfahren für IVDs in Taiwan, das von der TFDA überwacht wird, variiert je nach Risikoklasse des Produkts, ähnlich wie bei Medizinprodukten.
IVDs der Klassen I und II: Diese Produkte müssen nicht registriert werden und unterliegen weniger strengen regulatorischen Anforderungen als Produkte mit höherem Risiko.
Klasse III und neue IVDs: Diese Produkte müssen ein zweistufiges Prüfverfahren durchlaufen, das eine administrative und eine technische Prüfung umfasst.
Die Rolle eines taiwanesischen Agenten bei der Registrierung von Medizinprodukten
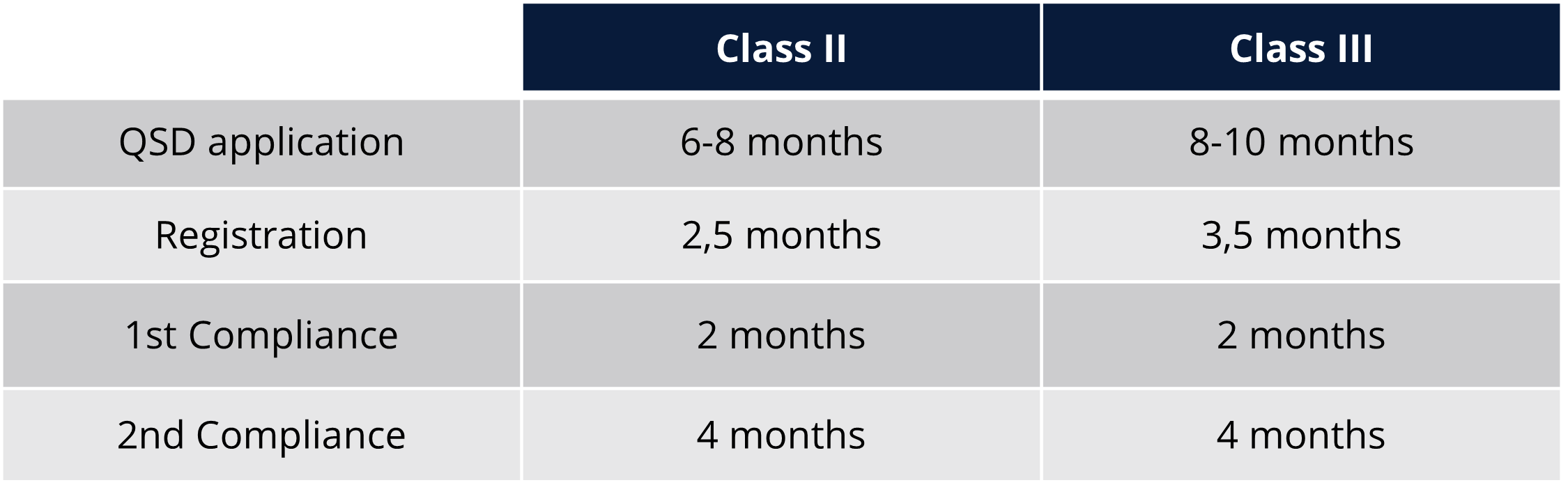
Regulierungsfristen und Gebühren für Taiwan
Klasse I (unsteril)
- Medizinprodukte der Klasse I ohne Markennamen (z. B. chirurgische Instrumente oder Stromversorgungszubehör) unterliegen in Taiwan in der Regel einem einfachen Selbstdeklarationsverfahren.
- Zeitplan: Das Genehmigungsverfahren für die Registrierung der Klasse I dauert etwa 3 Monate.
- EineListe von Produktender Klasse I kann durch das in Artikel 25 des Medizinproduktegesetzes beschriebene Auflistungsverfahren ab dem 1. Oktober 2021 registriert werden.Die Liste enthält 68 Produktcodes.
Wichtige Links und Leitfäden
Etikett hier
Lokaler Vertreter
Um Medizinprodukte oder In-vitro-Diagnostika (IVD) in Taiwan zu verkaufen, müssen Hersteller ohne lokale Niederlassung einen Vertreter für die Regulierung im Land ernennen, einen Taiwan-Agenten. Der Taiwan-Agent ist Ihre Verbindung zur taiwanesischen Lebensmittel- und Arzneimittelbehörde (TFDA) und ist entscheidend für die Einhaltung der taiwanesischen Vorschriften.
Ihr Taiwan-Agent muss:
- Eine rechtlich etablierte Einheit in Taiwan sein.
- Eine pharmazeutische Vertriebslizenz besitzen, um regulatorische Aktivitäten durchzuführen.
Der Taiwan-Agent bietet umfassende regulatorische Unterstützung, einschließlich:
- Einreichung der Registrierung: Vorbereitung und Einreichung aller erforderlichen Unterlagen bei der TFDA in Ihrem Namen.
- QSD-Genehmigung: Unterstützung bei der Erlangung des Genehmigungsschreibens für die Dokumentation des Qualitätssystems (QSD), das für Produkte der Klassen II, III und bestimmte Produkte der Klasse I obligatorisch ist.
- Regulatorische Kontaktperson: Wir fungieren als primäre regulatorische Verbindung zwischen Ihrem Unternehmen und der TFDA und erleichtern die Kommunikation und Einhaltung der Vorschriften.
- SAE-Meldung: Verwaltung der Berichterstattung über schwerwiegende unerwünschte Ereignisse (SAE), falls Probleme mit Ihrem Produkt auftreten.
- Wartung der Lizenz: Sicherstellung, dass die QSD-Lizenz und die Produktregistrierung auf dem neuesten Stand bleiben.
- Verwaltung der Produktlizenz für Medizinprodukte: Verwaltung Ihrer von der TFDA genehmigten Produktlizenz für Medizinprodukte, die für alle registrierten Produkte erforderlich ist.
Die Angaben Ihres taiwanesischen Vertreters müssen zusammen mit der Registrierungsnummer auf dem chinesischen Etikett Ihres Produkt erscheinen. Zusätzlich fügen die Vertriebshändler ihre Informationen in der Regel mit einem Aufkleber hinzu, um den lokalen Praktiken zu entsprechen.
Die Rolle des taiwanesischen Agenten ist von entscheidender Bedeutung für die Navigation durch die komplexe regulatorische Landschaft in Taiwan. Er stellt sicher, dass Ihr Produkt alle TFDA-Anforderungen erfüllt, sorgt für die Konformität Ihres Produkts und fungiert als Ihr lokaler Ansprechpartner für regulatorische Fragen.
Hersteller können ihr Geschäft auf den taiwanesischen Markt ausweiten, indem sie einen zuverlässigen Taiwan-Agenten beauftragen, der die Einhaltung der Vorschriften und einen reibungslosen Zulassungsprozess sicherstellt.
Setzen Sie sich mit uns in Verbindung, um zu erfahren, wie Qserve Sie bei der Ernennung eines Taiwan-Agenten und der Verwaltung Ihrer regulatorischen Anforderungen in Taiwan unterstützen kann.
Kontakt
Zulassungswege in Kanada
Regulierungsprozess
Möchte ein Hersteller von Medizinprodukten der Klasse I oder von In-vitro-Diagnostika seine Produkte direkt in Kanada vermarkten, ohne sich eines Vertriebshändlers zu bedienen, ist er verpflichtet, eine Medical Device Establishment License (MDEL) zu beantragen. Entscheidet sich der Hersteller für den Vertrieb über einen oder mehrere Vertriebshändler innerhalb Kanadas, müssen diese ebenfalls das Antragsverfahren für eine MDEL durchlaufen. Anders ausgedrückt: In Kanada ansässige Händler und Importeure müssen eine MDEL beantragen, unabhängig von der Risikoklassifizierung des Medizinprodukts oder In-vitro-Diagnostikums.
Für Hersteller von Produkten der Klassen II-IV, die ihre Produkte verkaufen wollen, ist die Beantragung einer MDL die Voraussetzung. Der wesentliche Unterschied zwischen einer MDEL und einer MDL liegt darin, dass die MDL eine Produktzulassung darstellt, während die MDEL eine Genehmigung für das Unternehmen, den Händler oder Importeur selbst ist.
Um eine MDL zu erhalten, müssen die Hersteller eine Zertifizierung nach dem Qualitätsmanagementsystem ISO 13485 im Rahmen des Medical Device Single Audit Program (MDSAP) nachweisen. Diese Zertifizierung muss mit den Spezifikationen der Health Canada Medical Regulations übereinstimmen.
Bei beiden Verfahren zur Beantragung von Lizenzen müssen die Dokumente in elektronischem Format bei Health Canada eingereicht werden, wobei die von Health Canada festgelegten Einreichungsanforderungen zu beachten sind.
Leitfaden-Dokumente
Marktzugang
Weitere Informationen
Kontaktieren Sie uns für weitere Informationen über den Marktzugang in Taiwan
Kontaktieren Sie uns für weitere Informationen über den Marktzugang in Taiwan
medizinische_Leistungen
Klassifizierung von Medizinprodukten in Taiwan
Das taiwanesische Regulierungssystem klassifiziert Produkte in die Klassen I, II und III, basierend auf dem Klassifizierungsschema der US FDA für Medizinprodukte.
- Produkt der Klasse I: Geringes Risiko
- Produkt der Klasse II:Mäßiges Risiko
- Produkt der Klasse-III:Hohes Risiko
Erfahren Sie, wie wir den Eintritt in den taiwanesischen Markt für Medizinprodukte vereinfachen können.
Zeitleiste
Regulierungsfristen und Gebühren
Der Umgang mit den taiwanesischen Vorschriften für Medizinprodukte kann eine Herausforderung sein, aber mit Qserve haben Sie einen zuverlässigen Partner, der den Prozess vereinfacht. Ganz gleich, ob Sie Hilfe bei der Entwicklung einer Strategie oder bei der Verwaltung der regulatorischen Anforderungen benötigen, wir bieten Ihnen maßgeschneiderte Unterstützung, um einen reibungslosen Marktzugang in Taiwan zu gewährleisten.
Setzen Sie sich noch heute mit uns in Verbindung, um zu erfahren, wie wir den Eintritt in den taiwanesischen Markt für Medizinprodukte vereinfachen können.
Etikett hier
Anforderungen an Qualität und klinische Compliance
Anforderungen an Qualität und klinische Compliance
Beschriftung
Das Etikett und die Gebrauchsanweisung müssen in Chinesisch verfasst sein.
Anforderungen an das technische Personal
Artikel 15 des Medizinproduktegesetzes schreibt vor, dass Hersteller und Importeure von Medizinprodukten ab dem 1. Mai 2021 technisches Personal benennen müssen. Die Verwaltungsmaßnahmen für Techniker für Medizinprodukte beschreiben die Anforderungen und Qualifikationen für technisches Personal für Medizinprodukte, das von allen Herstellern und Händlern benötigt wird. Für die neue Anforderung gilt eine dreijährige Übergangsfrist.
UDI-Anforderungen
Taiwan hat mit der schrittweisen Einführung von UDI begonnen, einschließlich der Anforderungen an die Kennzeichnung und die Datenbankmeldungen. Die "Anforderungen für die Angabe des Unique Device Identifier auf Etiketten von Medizinprodukten" traten am 1. Mai 2021 in Kraft. Zu den herausgebenden Stellen gehören GS1, HIBCC und ICCBBA.
Jetzt Unterstützung anfordern
server render fail/waiting for island-7f870ei1R0 (separate island render, inside)
