Vendredi dernier, la Commission européenne a publié un projet de règlement visant à modifier l'annexe VII du MDR de l'UE et du IVDR de l'UE. Dans ces deux textes, l'annexe VII définit les exigences relatives aux évaluations de la conformité effectuées par les organismes notifiés (NB) dans les cadres réglementaires européens pour les dispositifs médicaux et les dispositifs de diagnostic in vitro. Ces changements ont un impact direct sur les délais de mise sur le marché des dispositifs par les fabricants .
Dans ce blog, nous nous concentrerons sur l'impact sur les startups qui mettent leur premier dispositif sur le marché européen. Le règlement met l'accent sur la transparence concernant les coûts et les délais, ce qui facilite la planification de l'évaluation de la conformité dans le cadre de la stratégie de mise sur le marché d'une startup .
Bien que l'annexe VII soit destinée aux organismes notifiés, il est essentiel de noter que la coopération entre les organismes notifiés et les fabricants est bidirectionnelle et qu'une participation active est attendue de la part des fabricants afin de garantir un accès au marché en temps voulu sans encourir de coûts élevés .
Une nouvelle exigence pour les NB est qu'il devrait y avoir une possibilité dans le processus de cotation pour le demandeur de donner des informations sur le fait que la société est, en fait, une PME. (moins de 250 employés et moins de 50 millions d'euros de chiffre d'affaires annuel).
Le devis ultérieur doit inclure les coûts totaux requis pour effectuer l'évaluation complète de la conformité, ainsi qu'une estimation des coûts supplémentaires potentiels .
La deuxième partie du nouveau règlement se concentre sur les délais que l'organisme notifié doit respecter:
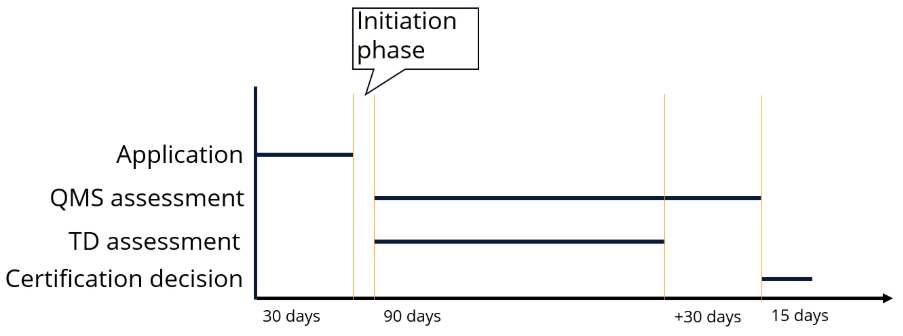
Pour entamer l'évaluation de la conformité avec l'organisme notifié après la signature du contrat, une demande officielle doit être soumise, qui comprend les informations de base déjà fournies concernant le système de gestion de la qualité et le dispositif .
Ensuite, le NB entame l'évaluation du QMS et de la DT, qui doit se dérouler en parallèle et qui sera liée, car l'audit devra prendre en compte certains aspects de l'examen préliminaire de la DT en cours de route.
L'organisme notifié doit utiliser le délai le plus court possible, en tenant compte du type de dispositif et de l'entreprise. Cette durée doit également être précisée par écrit.
Les délais mentionnés dans le règlement sont unilatéraux et doivent être respectés par l'organisme notifié. Comme indiqué précédemment, l'ensemble du processus est une coopération bilatérale. Cela signifie que du côté du fabricant, certains efforts sont attendus pour répondre aux questions de le NB. Les délais d'évaluation seront interrompus dans ces cas. La fréquence à laquelle cela peut se produire est précisée comme suit:
- Phase de demande: 1 fois
- Évaluation du QMS: 3 fois
- Évaluation de la DT: 3 fois
Les deux parties doivent convenir de la durée de ces interruptions et cet accord doit également être consigné par écrit.
|
Informations obligatoires par le NB |
Accords entre l'organisme notifié et le fabricant |
|
Augmentation des coûts initialement prévus, y compris la justification de cette augmentation |
Durée des interruptions de l'évaluation de la conformité |
|
Interruption de l'évaluation de la conformité en raison de l'avis de l'EMA, d'un groupe d'experts, d'une autorité réglementaire ou d'un laboratoire de référence de l'UE |
Durée totale de l'évaluation |
|
|
Prolongation des délais convenus |
Comme indiqué précédemment, ce document est encore à l'état de projet et ouvert aux commentaires. La publication officielle est prévue pour le deuxième trimestre 2026 et prendra effet trois mois plus tard. Vous pouvez adapter votre planification en conséquence si vous êtes dans une phase de démarrage de votre évaluation de la conformité avec l'organisme notifié. Une partie de votre stratégie devrait inclure un ou plusieurs dialogues structurés avec l'organisme notifié avec lequel vous travaillerez pour assurer une bonne communication et une utilisation optimale des délais.
Grâce à ces nouveaux délais, le marché européen peut à nouveau rivaliser avec le marché américain et son cadre réglementaire .
Avez-vous besoin d'aide pour votre stratégie d'accès au marché ou pour la préparation de votre procédure d'évaluation de la conformité?


